Samenvatting voor scheikunde - Chemisch rekenen
Grootheden, eenheden en symbolen
Eenheden en grootheden lijken een beetje op elkaar. Hierbij geven we een overzicht van alle belangrijke dingen die je moet kennen. Hopelijk schept het een beetje duidelijkheid in de scheikundige warboel.
Massa
Ten eerste de grootheid massa, met symbool m. Als het goed is ken je deze wel. Dit geeft aan hoe zwaar iets is. En, hoe zwaar iets is drukken we uit in gram (g), of kilogram (kg), wat ook 1000 gram is.
Atoommassa
Een andere grootheid die we moeten kennen die hiermee te maken heeft is atoommassa, met symbool A. Dit is, je raadt het al, het gewicht van een atoom. Aangezien het atoom super klein is, is het onhandig om te rekenen met kilogram. Een proton weegt namelijk 1,66 x 10−27 kg! Daarom hebben onze slimme scheikunde-mensen bedacht om dit gewicht van 1,66 x 10−27 u te noemen. Een proton weegt dus 1 u. Zo kunnen we handig de atoommassa van een atoom aanduiden met de eenheid u.
Relatieve atoommassa
Soms wordt ook de relatieve atoommassa gebruikt, met symbool Ar (r van relatief). Dit is gewoon de atoommassa gedeeld door 1u. Een koolstofatoom (C) weegt bijvoorbeeld ongeveer 12u. De relatieve atoommassa van een koolstofatoom is dan ook 12. Let op, aangezien we een gewicht door een ander gewicht delen, is er geen eenheid, gewoon een getal, in dit geval 12.
Molecuulmassa
Op dezelfde manier kunnen we de molecuulmassa, met symbool M, gebruiken. Dit is het gewicht van een molecuul, uitgedrukt in u. En de relatieve molecuulmassa, wat weer het gewicht van het molecuul gedeeld door 1u is, met symbool Mr (r van relatief).
Chemische hoeveelheid
Een belangrijke grootheid is de chemische hoeveelheid. Dit heeft als symbool n(X). Met de chemische hoeveelheid geven we aan hoeveel deeltjes in een bepaalde hoeveelheid stof aanwezig zijn. Dit zijn doorgaans onvoorstelbaar veel deeltjes, dus dat is onhandig om mee te rekenen. Daarom gebruiken we de eenheid mol.
Een mol is dan simpelweg een hele grote hoeveelheid, bij benadering 6,02 x 1023 . Dit getal noemen we ook wel het getal van Avogadro, wat ook wel wordt uitgedrukt met het symbool NA. Als we het hebben over één mol van een stof, dan hebben we het dus over 6,02 x 1023 deeltjes.
Molaire massa
Een mol is dus een vaste hoeveelheid deeltjes. Maar, per stof verschilt het natuurlijk hoeveel een deeltje weegt, en daarom ook hoeveel een mol deeltjes weegt. Daarom gebruiken we ook nog een grootheid molaire massa, met symbool M(X). Deze molaire massa drukken we uit in gram per mol, dus hoeveel gram een mol van die stof weegt. De hoeveelheid deeltjes (dus chemische hoeveelheid) geven we aan met n(X), uitgedrukt in mol, en het gewicht van die hoeveelheid (dus molaire massa) geven we aan met M(X) uitgedrukt in gram per mol (g mol−1).
Massapercentage
Het kan ook dat we geïnteresseerd zijn in het massapercentage, vanzelfsprekend uitgedrukt in percentages. Dit is van belang als het geheel bestaat uit meerdere stoffen. We willen dan weten welk percentage van de massa van het geheel toe te wijzen is aan een specifieke stof. Je deelt dan dus simpelweg de massa van de aanwezige stof door de massa van het geheel, en doet dat keer 100%.
Massa-ppm
We kunnen iets ook uitdrukken in massa-ppm, waarbij ppm staat voor parts per million (deeltjes per miljoen). Als we het hebben over massa-ppm van een stof in het geheel, dan bedoelen we dat één miljoenste deel van de massa van het geheel bestaat uit die stof. In een kilogram zit 1000 gram, en in een gram zit 1000 milligram, dus in een kilogram zit een miljoen milligram. De eenheid van massa-ppm is daarom in mg kg−1; in elke kilogram van het geheel zit een milligram van die stof.
Massa-ppb
Datzelfde kunnen we doen met massa-ppb, waarbij ppb staat voor part per billion, (deeltjes per miljard). Niet in de war raken hierbij, in het Engels is billion een miljard en niet een biljoen. Als we het hebben over de massa-ppb van een stof in het geheel, dan bedoelen we dat één miljardste deel van de massa van het geheel bestaat uit die stof. In een kilogram zit 1000 gram, en in een gram zit 1000 milligram, en in een milligram zit 1000 microgram, dus in een kilogram zit een miljard microgram. De eenheid van massa-ppb is daarom in µg kg−1; in elke kilogram van het geheel zit een microgram van die stof.
Volume
Dan eentje die je bekend moet voorkomen, namelijk volume, met als symbool V. Dit geeft aan hoeveel ruimte iets inneemt, en drukken we uit in kubieke meter m3.
Volumepercentage
Het volumepercentage werkt hetzelfde als het massapercentage, maar dan dus voor volume. Dus, welk percentage van het volume van het geheel neemt een specifieke stof in. Dit berekenen we dus simpelweg door het volume van de stof te delen door het volume van het totaal en dat x 100% te doen.
Volume-ppm
Het volume-ppm is op dezelfde manier als bij massa het miljoenste deel van het volume. Er passen 1000 kubieke decimeters in een kubieke meter en er passen 1000 kubieke centimeters in een kubieke decimeter, dus 1 kubieke centimeter is één miljoenste kubieke meter. We drukken het volume-ppm dan ook uit in kubieke centimeter per kubieke meter (cm3 m−3). Dit kan overigens ook uitgedrukt worden in microliter per liter. Als een stof dus 1 volume-ppm is van het geheel, dan neemt de stof 1 kubieke centimeter per kubieke meter in van het geheel (of 1 microliter per liter).
Molair volume
We kunnen ook het molair volume uitdrukken, met symbool Vm . Dit is, niet al te verrassend, het volume dat een mol van een bepaalde stof heeft. Dit drukken we dan ook uit in kubieke meter per mol (m3 mol−1).
Dichtheid
Dan dichtheid, met symbool ρ. Hiermee geven we aan hoe zwaar een stof is per volume. Een kubieke meter van de ene stof kan veel zwaarder zijn dan een kubieke meter van een andere stof. We drukken dichtheid dan ook uit met de eenheid kilogram per kubieke meter (kg m−3), dus hoe zwaar is een blok van een kubieke meter van die stof? Hoe groter de dichtheid, hoe zwaarder. Hieruit valt dus ook de relatie te halen:  .
.
Concentratie
Met de concentratie kunnen we aangeven hoeveel stof er is opgelost per hoeveelheid oplossing. Concentratie geven we aan met het symbool c(X) of met [X]. We willen hiermee dus aangeven hoeveel deeltjes van een stof in een oplossing zit, dus dit doen we logischerwijs met de eenheid mol per liter (mol L−1): het aantal deeltjes per liter. We kunnen hierin dus de relatie herkennen: 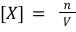 (n = chemische hoeveelheid in mol).
(n = chemische hoeveelheid in mol).
Zuurgraad
Bij chemisch rekenen is ook de zuurgraad vaak een belangrijk onderdeel. Dit is de mate waarin een oplossing zuur of basisch is. Doorgaans drukken we dit uit in pH. De pH is de -log[H+]. Hoe hoger de concentratie H+, hoe meer H+jes er dus aanwezig zijn, hoe lager de pH waarde, hoe zuurder de oplossing. Een zure oplossing heeft dus een lage pH.
Andersom kan je ook de pOH gebruiken, dit is de -log[OH-]. Hoe hoger de concentratie OH-, hoe meer OH-jes er dus aanwezig zijn, hoe lager de pOH waarde, hoe basischer de oplossing. Bij elkaar opgeteld zijn pH en pOH altijd 14 (bij 298 graden Kelvin). Als je één van de twee weet, dan weet je de ander dus ook. Je kan de vergelijking pH = - log [H+] natuurlijk ook omschrijven naar , waardoor je ook de concentratie H+ kan berekenen als je de pH weet. Hetzelfde geldt voor pOH = - log [OH-] naar
, waardoor je ook de concentratie H+ kan berekenen als je de pH weet. Hetzelfde geldt voor pOH = - log [OH-] naar 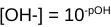 .
.
Reactiesnelheid
En ten slotte hebben we nog de reactiesnelheid, met symbool s. Hiermee geven we aan hoe snel een reactie verloopt. Dit is dus per reactie verschillend. Er is een aantal factoren die hier van invloed zijn, zoals de deeltjesgrootte, concentratie, temperatuur en katalysatoren. De eenheid voor de reactiesnelheid is mol per liter per seconde (mol L−1 s−1). Hierbij kunnen we de relatie herkennen:  (verandering in concentratie gedeeld door de verandering in tijd).
(verandering in concentratie gedeeld door de verandering in tijd).
Principes bij chemisch rekenen
Een aantal principes is van belang bij het rekenen aan chemische processen, daarvan bespreken we nu de belangrijkste.
1. Ten eerste de massaverhouding. Dit is de verhouding in massa waarbij stoffen volledig met elkaar reageren. Als de massaverhouding tussen stof X en stof Y 1:2 is, dan moet er dus twee keer zoveel massa van stof Y aanwezig zijn als van stof X om volledig te reageren. Deze massaverhouding verschilt voor elk tweetal stoffen weer.
2. De stoichiometrische verhouding geeft dan de verhouding in deeltjes aan waarbij de stoffen volledig met elkaar reageren. Dit wordt vaak uitgedrukt in de molverhouding, maar in principe maakt het niet zoveel uit op welke schaal je de verhouding doet; de verhouding voor een paar deeltjes is hetzelfde als voor een mol deeltjes. Als de molverhouding voor stof A en stof B dan bijvoorbeeld 3:1 is, dan heb je dus 3 keer zoveel mol van stof A nodig als van stof B om volledig te reageren.
3. Ten derde moet je weten dat de volumeverhouding bij gassen, dus hoeveel ruimte de gassen innemen relatief aan elkaar, hetzelfde is als de molverhouding van die aanwezige gassen.
4. Ten vierde is er de overmaat en ondermaat. Dit heeft met hetzelfde te maken. Als de massaverhouding of molverhouding bijvoorbeeld niet helemaal klopt, dan blijft er een deel van één van de twee beginstoffen over. Dat overschot is de overmaat. De beginstof die volledig heeft gereageerd is in ondermaat.
5. Ten slotte moet je ook begrijpen dat het rendement van een reactie een fractie of percentage is van de theoretische opbrengst. Dat wil zeggen, bij een chemische reactie is er een maximale te verkrijgen hoeveelheid van een stof die je verwacht, in theorie. Dit kan je berekenen. Maar, in de werkelijkheid verloopt een experiment doorgaans niet perfect, waardoor de praktische opbrengst verschilt van de theoretische opbrengst. Het rendement kan je dan berekenen door de praktische opbrengst te delen door de theoretische opbrengst.




