Wat is een molecuulformule en hoe bereken je die?
Bij het vak scheikunde zul je het begrip “molecuulformule” regelmatig tegenkomen. Het is dus belangrijk dat je begrijpt wat het betekent, maar ook dat je weet hoe je molecuulformules kunt berekenen. Op deze pagina leggen we dat daarom aan je uit! Voor duidelijke visuele uitleg kun je daarnaast altijd terecht bij onze uitlegvideo’s voor scheikunde.
Wat is een molecuulformule?
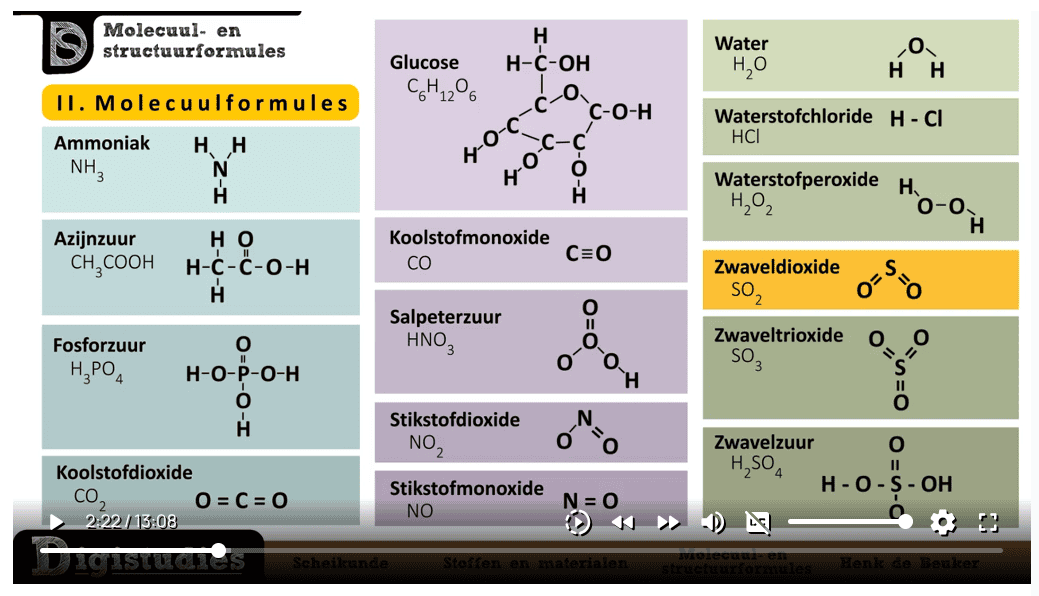
Een molecuulformule geeft aan uit welke atomen een molecuul bestaat. Ook lees je de hoeveelheid van elk atoom eraan af. Het vertelt je dus de exacte samenstelling van een stof.
Voorbeeld: De molecuulformule van water is H₂O. Dit betekent:
- 2 waterstofatomen (H)
- 1 zuurstofatoom (O)
Hoe bereken je een molecuulformule?
Soms weet je welke elementen er in een stof zitten en hoeveel procent van elk, maar nog niet de precieze molecuulformule. Volg dan deze stappen:
Stap 1: Begin met de gegeven percentages
Bijvoorbeeld:
- 40% koolstof ( C )
- 6,7% waterstof (H)
- 53,3% zuurstof (O)
Stap 2: Deel elk percentage door het atoomgewicht (massa per mol)
Gebruik de volgende afgeronde waardes:
- C = 12
- H = 1
- O = 16
Berekening:
- C: 40 ÷ 12 ≈ 3,33
- H: 6,7 ÷ 1 = 6,7
- O: 53,3 ÷ 16 ≈ 3,33
Stap 3: Maak er een simpele verhouding van
De getallen hierboven vormen ongeveer:
- C : H : O = 3,33 : 6,7 : 3,33
Deel alles door het kleinste getal (3,33):
- C ≈ 1
- H ≈ 2
- O ≈ 1
Je krijgt dan de verhouding: CH₂O. Dit noem je de verhoudingsformule of empirische formule.
Stap 4: Kijk of het molecuul groter is
Soms weet je ook de massa van het hele molecuul, bijvoorbeeld 180 u (de eenheid van molecuulmassa).
- CH₂O weegt 12 + 2 + 16 = 30 u
- 180 ÷ 30 = 6 → Dus het molecuul is 6× zo groot
De molecuulformule is dus C₆H₁₂O₆.
Samengevat
Wat doe je? Stap 1: Schrijf de percentages op Stap 2: Deel door atoommassa's Stap 3: Zet om naar een eenvoudige verhouding Stap 4: Vermenigvuldig als nodig tot je bij de echte molecuulformule bent
Oefenvraag: bereken de molecuulformule
Een onbekende stof bestaat uit:
-
52,2% koolstof ( C )
-
13,0% waterstof (H)
-
34,8% zuurstof (O)
De massa van één molecuul van deze stof is 92 gram per mol.
Vraag: Wat is de molecuulformule van deze stof?
Let op! Het antwoord vind je hieronder, dus lees niet verder als je de opgave eerst wil maken!
Uitgewerkt antwoordmodel:
Stap 1:
- C: 52,2 ÷ 12 = 4,35
- H: 13,0 ÷ 1 = 13,0
- O: 34,8 ÷ 16 = 2,18
Stap 2: Deel alles door 2,18 (kleinste getal):
- C: 4,35 ÷ 2,18 ≈ 2
- H: 13,0 ÷ 2,18 ≈ 6
- O: 2,18 ÷ 2,18 = 1
Empirische formule = C₂H₆O
Stap 3: Massa van C₂H₆O = (2×12) + (6×1) + (1×16) = 46 g/mol
Stap 4: Molecuulmassa is 92 → 92 ÷ 46 = 2
Molecuulformule = C₄H₁₂O₂
Meer weten over molecuulformules?
Wil je meer weten over molecuulformules en andere onderwerpen die daarmee te maken hebben? Bekijk dan al onze uitlegvideo’s voor scheikunde! Video’s waarin molecuulformules besproken worden zijn bijvoorbeeld: Molecuulformules (vmbo-t), Molecuul- en structuurformules (havo en vwo), Lewisstructuren, formele lading, en partiële lading (vwo), Isomeren (vwo)
Benieuwd naar hoe wij jou kunnen helpen met leren? In de video hieronder kun je zien hoe het leerplatform eruit ziet en hoe het werkt als je producten hebt aangeschaft:
Digistudies, hét e-learning platform voor scholieren
- Goedkoper dan bijles
- Scoor gemiddeld een punt hoger!
- Gecontroleerd door docenten
- Slechts €249,00 voor producten, voor alle vakken
